CSCO第一直播间 | TROP2 ADC疗法在NSCLC治疗中多维并进,展现广阔发展前景
第27届全国临床肿瘤学大会暨2024年中国临床肿瘤学会(CSCO)学术年会于2024年9月25日至29日在厦门盛大召开。秉承“以患为本,共享未来”的主题和“团结、协作、务实”的根本宗旨,本届CSCO大会与指定合作媒体医脉通共同打造了“第一直播间”特别栏目,聚焦领域前沿进展,为学术观点的交流碰撞提供舞台,共探临床肿瘤学领域新观念和新动态。
近年来,滋养细胞表面糖蛋白抗原2(TROP2)抗体偶联药物(ADC)在晚期非小细胞肺癌(NSCLC)领域取得了众多令人瞩目的研究进展,有望替代化疗,成为新的治疗选择。为深入讨论TROP2-ADC取得的最新进展,“CSCO第一直播间”精心打造“TROP2 ADC在NSCLC的探索之旅专场”,特别邀请到上海交通大学医学院附属胸科医院储天晴教授、湖南省肿瘤医院邬麟教授以及华中科技大学同济医学院附属同济医院褚倩教授共同做客直播间,畅谈TROP2 ADC在NSCLC诊疗领域的研究进展与未来探索方向。

佳音不断,实力出圈,TROP2 ADC为EGFR突变耐药NSCLC带来新生机
褚倩教授:ADC药物素有“魔法子弹”之称,在肺癌等多个瘤种治疗中崭露头角。请您结合近期公布的临床研究,谈谈TROP2 ADC在酪氨酸激酶抑制剂(TKI)耐药的EGFR突变阳性晚期NSCLC中取得的进展及突破?
邬麟教授:EGFR-TKI耐药机制主要有EGFR通路依赖性和EGFR通路非依赖性两大类,EGFR通路依赖性耐药主要体现为EGFR基因的扩增及继发性突变。例如一/二代 EGFR-TKI 耐药后最常见的T790M 突变、三代EGFR-TKI耐药后常见的C797S突变及其他溶剂前沿突变;EGFR通路非依赖性机制涵盖了EGFR旁路激活、下游信号通路基因的改变以及组织学表型的转化,包括 MET扩增、HER2扩增、BRAF变异、RET融合等1。同时亦存在部分患者耐药机制尚待阐明,亟需临床进一步探索。
针对上述耐药机制,已有若干治疗策略处于研发或临床试验阶段。针对C797S等特定突变,四代TKI已进入I期人体试验,尽管进展相对缓慢,但展现出了一定的治疗潜力。对于存在MET扩增的人群,已有多项MET-TKI联合EGFR-TKI的临床研究展示出不俗的疗效2-4。对于耐药机制不明的患者,传统上采用化疗为主的治疗方案5。随着研究的深入,化疗联合抗血管生成药物及免疫治疗已成为新的治疗选择6。近两年来,TROP2 ADC在TKI耐药的EGFR突变阳性NSCLC领域同样展现了颇具意义的探索进展。
KL264-01研究是一项旨在探索芦康沙妥珠单抗在既往经治实体瘤患者中的疗效与安全性的Ⅰ/Ⅱ期临床研究。在今年AACR大会中,该研究更新了Ⅱ期拓展队列中NSCLC患者的疗效数据。截至2023年11月22日,中位随访时间为17.2个月。共入组了43例经治的晚期NSCLC患者,其中22例为EGFR突变患者,且近半数(45.5%)既往接受过三代EGFR-TKI治疗。结果显示,整体人群客观缓解率(ORR)为43.6%。值得特别关注的是,EGFR突变患者组ORR达到60.0%,中位无进展生存期(mPFS)长达11.5个月,中位总生存期(mOS)达22.7个月,显著提升了EGFR突变耐药患者的生存预后。此外,芦康沙妥珠单抗在耐受性方面表现良好,未发生因治疗相关不良事件(TRAE)导致的停药或死亡事件7。目前,芦康沙妥珠单抗的III期临床试验已顺利完成入组,期待最终的结果可以进一步增强我们对TROP2 ADC在TKI耐药的EGFR突变阳性晚期NSCLC应用的信心。
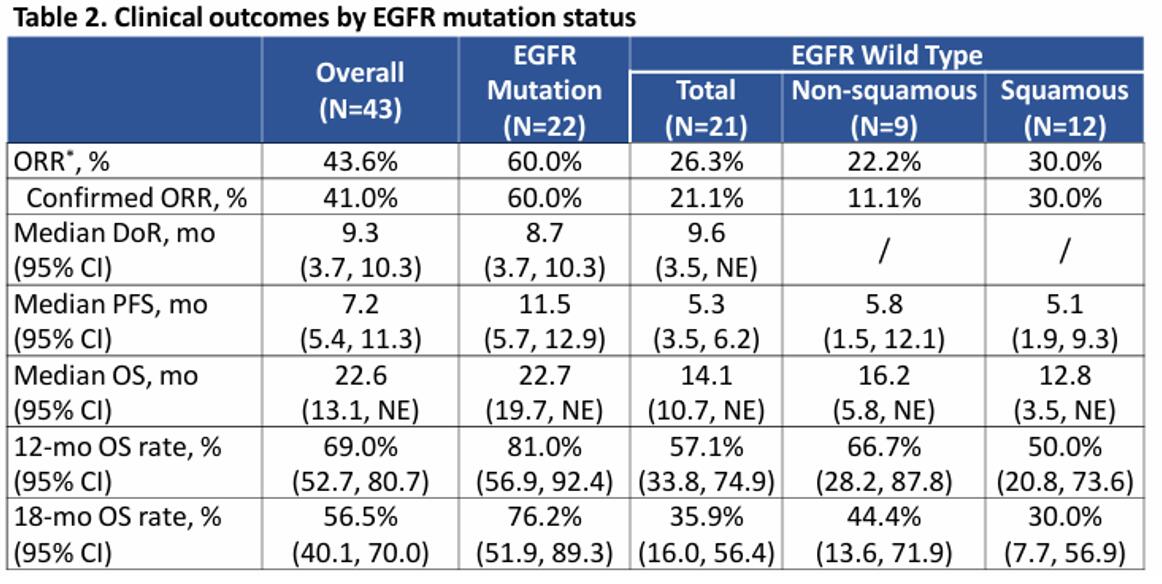
图1. KL264-01研究NSCLC人群获益情况
此外,TROPION-Lung05研究也为我们提供了宝贵信息,该研究评估了Dato-DXd在既往经治的伴有可靶向基因组改变(AGAs)晚期/转移性NSCLC患者中的疗效和安全性。研究共纳入137例AGA患者,其中EGFR突变比例为57%。2023 ESMO年会公布的结果显示,所有人群的ORR为35.8%,疾病控制率(DCR)为78.8%,mPFS为5.4个月。其中EGFR突变人群(n=78)的ORR分别为43.6%,DCR为82.1%,mPFS为5.8个月8。TROPION-Lung01研究也展示出相似的结果9。
因此,无论国产TROP2 ADC还是进口TROP2 ADC,均预示着在TKI耐药的EGFR突变阳性NSCLC中广阔的应用前景。我们期待未来的研究能够提供更多数据,这对于支持并优化TROP2 ADC在EGFR突变耐药NSCLC中的治疗策略至关重要。
晚期NSCLC一线治疗新突破,TROP2 ADC+免疫治疗±化疗值得期待
褚倩教授:TROP2 ADC在驱动基因阴性NSCLC临床诊疗中同样进行了多方面的探索,其研究结果如何?未来随着更多数据的公布,TROP2 ADC联合免疫治疗模式将对驱动基因阴性NSCLC一线治疗带来哪些影响?
储天晴教授:在驱动基因阴性的NSCLC中,TROP2 ADC也进行了积极的探索,在后线治疗中,多个药物与标准治疗方案多西他赛做了头对头的比较。最值得关注的研究是两项III期临床研究—EVOKE-01和TROPION-Lung01。EVOKE-01研究结果显示,虽然戈沙妥珠单抗组表现出更长的mOS(11.1个月),但与多西他赛组并无显著性差异(mOS:9.8个月,p=0.0534)10。TROPION-Lung01研究结果显示,相较多西他赛,Dato-DXd虽然改善了意向治疗(ITT)人群的mPFS(4.4个月 vs 3.7个月,HR=0.75,p=0.008),但未能显著改善mOS(12.9个月 vs 11.8个月,HR=0.94,p=0.530)9,11。该两项研究结果提示,TROP2 ADC在驱动基因阴性NSCLC的后线治疗中可能需要继续细分人群,找到更加获益群体。
除了后线的探索,TROP2 ADC在驱动基因阴性NSCLC一线治疗中的探索亦是如火如荼,OptiTROP-Lung01研究是一项非随机Ⅱ期研究,旨在探索芦康沙妥珠单抗+KL-A167(PD-L1抑制剂)在未经治的晚期/转移性NSCLC患者中的疗效与安全性。该研究分为两个队列,队列1A(n=40,芦康沙妥珠单抗5mg/kg Q3W+KL-A167 1200mg Q3W)和队列1B(n=63,芦康沙妥珠单抗5mg/kg Q2W+KL-A167 900mg Q2W)。
结果显示,队列1A (Q3W方案)和队列1B( Q2W方案)ORR分别为48.6%和77.6%,mPFS分别为15.4个月和NR。研究者进一步分析了队列1B亚组数据。结果显示,无论PD-L1表达以及组织学如何,各亚组均达到较高的ORR。此外,该亚组分析显示, PD-L1 TPS表达阳性患者ORR超过80% 12。在安全性方面,芦康沙妥珠单抗+KL-A167的不良事件可控可管理,该联合疗法的安全性与单药一致,没有产生新的安全性信号。

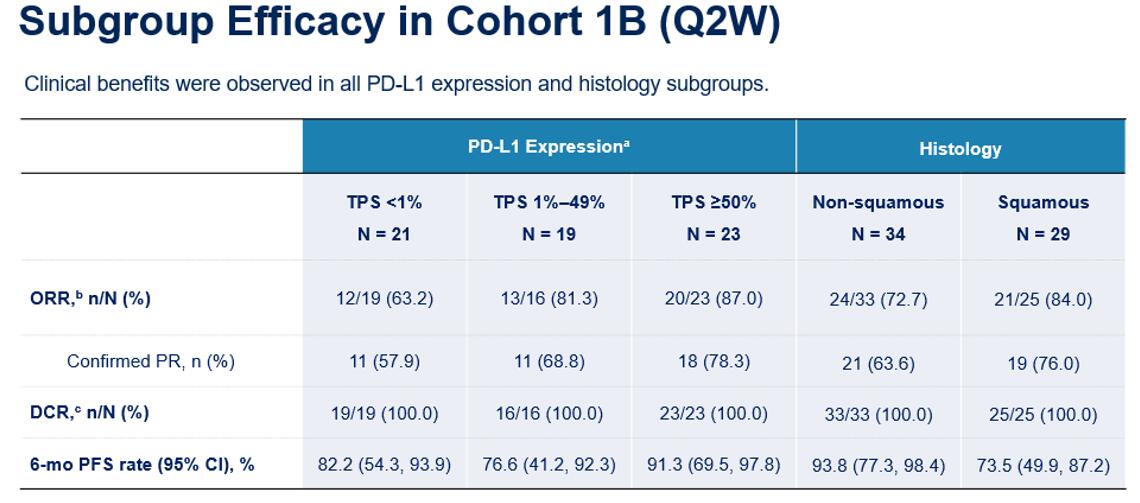 图2. OptiTROP-Lung01研究队列1B亚组疗效分析
图2. OptiTROP-Lung01研究队列1B亚组疗效分析
目前,Ⅲ期临床研究TroFuse-007正在积极开展,旨在进一步评估芦康沙妥珠单抗与帕博利珠单抗联合治疗与帕博利珠单抗单药治疗在PD-L1 TPS≥50%患者中的疗效与安全性。
此外,Dato-DXd的TROPION-Lung02研究和戈沙妥珠单抗的EVOKE-02研究也在探索TROP2 ADC联合免疫及化疗在无驱动基因突变的NSCLC患者一线治疗中的安全性和有效性。这两项研究均取得了初步积极的ORR和PFS数据13-15。基于这些积极的探索性研究结果,更多针对TROP2 ADC联合免疫治疗在驱动基因阴性NSCLC一线治疗中的Ⅲ期临床研究正在进行,驱动基因阴性NSCLC有望迎来一线治疗新选择。
肺癌围术期治疗模式再创新,ADC药物应用潜力初显
褚倩教授:随着抗肿瘤治疗药物以及肺癌外科治疗技术的不断发展,越来越多的患者通过围术期药物治疗获得了手术治疗的机会,并得到了长生存获益。此次CSCO大会中,有学者带来了TROP2 ADC用于可手术NSCLC围术期治疗的相关研究,您认为TROP2 ADC在这一领域的临床应用潜力如何?
邬麟教授:随着免疫治疗在NSCLC领域的快速发展,围术期或新辅助免疫联合化疗的模式已被证实有效,并被纳入多个权威指南。然而,该领域仍有大量未满足的临床需求。为了进一步提高疗效,研究人员正在探索将新型药物,如ADC纳入围术期治疗方案的可能性。TroFuse-019研究是一项III期临床研究,给予无EGFR突变的II至III期(N2)NSCLC患者帕博利珠单抗联合化疗新辅助治疗。术后未达pCR且影像学评估为无疾病状态的患者将进入辅助治疗阶段,并以1:1的比例随机接受芦康沙妥珠单抗联合帕博利珠单抗辅助治疗或帕博利珠单抗单药辅助治疗。该研究有望解答芦康沙妥珠单抗的加入能否进一步改善新辅助免疫联合化疗后未达pCR患者的长期生存获益。
在2024年世界肺癌大会(WCLC)上公布的NeoCOAST-02研究是一项多中心、多臂的II期研究,其中队列4患者采用度伐利尤单抗联合Dato-DXd联合化疗作为新辅助治疗方案,随后进行度伐利尤单抗的辅助治疗。在最终入组的54例患者中,39例完成了新辅助治疗,46例患者接受了手术治疗。在调整意向治疗(mITT)人群中,队列4的病理完全缓解(pCR)率为34.1%,主要病理缓解(MPR)率为65.9%。其中PD-L1表达阳性及高表达人群的pCR率分别为37.5%和41.2%16。总体而言,TROP2 ADC药物的加入,使pCR率和MPR率均有了一定程度的提高。我们希望这种提高能够最终转化为患者的生存获益,并期待未来有更具说服力的数据或前瞻性的随机对照研究来进一步验证。
机遇与挑战并存:持续优化ADC治疗策略的探索之路
褚倩教授:TROP2 ADC临床研发正如火如荼地展开,并有望改写临床实践。作为深度参与TROP2 ADC研究的研究者,能否请您结合临床研究经验谈谈TROP2 ADC在未来应用过程中需要注意的事项?未来TROP2 ADC在NSCLC诊疗领域有哪些值得进一步探索的方向?
储天晴教授:ADC药物的安全性管理是临床应用中的重要考虑因素,同时也是未来研究的关键方向。ADC的疗效和毒性与靶点、抗体特性、偶联药物及连接子等因素紧密相关。ADC药物的不良反应主要分为两类:on-target但off-tumor,以及off-target和off-tumor。
第一类不良反应发生在ADC药物本应靶向肿瘤细胞的特定靶点,但由于这些靶点在非肿瘤组织中也有表达,例如皮肤或口腔黏膜,导致药物在非预期部位产生毒性。第二类不良反应则涉及药物设计或递送过程中的问题,如细胞毒药物的剂量过高,或ADC药物在未到达肿瘤细胞前提前解离释放细胞毒素,从而引起广泛的毒性反应,包括血液学毒性和胃肠道反应等。此外,ADC的抗体部分在未能有效结合肿瘤抗原时,可能错误地与免疫细胞的Fc段受体结合,导致免疫相关不良反应,如免疫性肺炎等。了解这些原理后,我们认识到不同肿瘤使用不同的ADC药物同样会产生不同的不良反应。例如,胃肠道肿瘤患者使用ADC药物可能会面临更大的胃肠道反应风险,而肺部肿瘤患者则可能有更高的肺炎发生概率。因此,针对不同的靶点和肿瘤类型,ADC药物的不良反应也各不相同。
未来的研究方向不仅包括对不良反应的进一步关注,还涉及联合治疗策略的探索。ADC药物作为一种先进的化疗药物,可以与靶向治疗、小分子TKI、抗血管生成药物,甚至是化疗药物或免疫治疗联合使用。虽然这些联合治疗策略理论上看似简单,但实际实施起来却非常复杂,需要临床医师仔细平衡疗效与毒性。此外,ADC药物的耐药机制也是未来研究的重要方向。肿瘤细胞可能通过下调靶点抗原的表达或通过其他机制将药物泵出肿瘤细胞,从而产生耐药性。这些耐药机制的探索对于开发新一代ADC药物至关重要。
邬麟教授:众所周知,ADC药物是针对特定靶点设计的。目前的研发策略旨在覆盖所有潜在的患者群体,不论其靶点表达状态如何。在今年WCLC大会上,TROPION-Lung01研究的回顾性分析创新性地采用定量连续评分法(QCS)病理学平台技术计算TROP2归一化膜比值(NMR),更客观全面地评估TROP2蛋白表达特征。研究结果显示,在总体可评估人群中,与TROP2 QCS-NMR-患者相比,TROP2 QCS-NMR+人群接受Dato-DXd治疗的ORR(32.7% vs. 16.9%)及中位PFS(6.9 vs. 2.9)均更优,且治疗与生物标志物状态之间存在交互效应(P=0.0063)17。因此,未来TROP2 ADC药物的研发,除了致力于拓宽适应证范围外,更需深入思考并明确哪些患者群体能够真正从中获益。这要求我们不断完善病理监测体系,以期建立起一套公认且科学的诊断标准。唯有如此,我们才能精准筛选出最有可能从TROP2 ADC治疗中获益的患者,确保治疗的有效性和资源的合理配置。同样的,这一思路也应贯穿于其他ADC药物的研发过程中,它不仅是当前研究的热点,更是未来药物研发中具备持久生命力的关键所在。
参考文献
- Chhouri H, Alexandre D, Grumolato L. Mechanisms of Acquired Resistance and Tolerance to EGFR Targeted Therapy in Non-Small Cell Lung Cancer.Cancers (Basel). 2023;15(2):504. Published 2023 Jan 13.
- Myung-Ju Ahn, Filippo de Marinis, Laura Bonanno, et al. MET Biomarker-based Preliminary Efficacy Analysis in SAVANNAH: savolitinib+osimertinib in EGFRm NSCLC Post-Osimertinib. 2022WCLC EP08.02-140.
- Wu YL, Zhang L, Kim DW, et al. Phase Ib/II Study of Capmatinib (INC280) Plus Gefitinib After Failure of Epidermal Growth Factor Receptor (EGFR) Inhibitor Therapy in Patients With EGFR-Mutated, MET Factor-Dysregulated Non-Small-Cell Lung Cancer .J Clin Oncol. 2018;36(31):3101-3109.
- Wu YL, Cheng Y, Zhou J, et al. Tepotinib plus gefitinib in patients with EGFR-mutant non-small-cell lung cancer with MET overexpression or MET amplification and acquired resistance to previous EGFR inhibitor (INSIGHT study): an open-label, phase 1b/2, multicentre, randomised trial.Lancet Respir Med. 2020;8(11):1132-1143.
- 中国临床肿瘤学会.非小细胞肺癌诊疗指南.2024年版
- Lu S, Wu L, Jian H, et al. Sintilimab plus bevacizumab biosimilar IBI305 and chemotherapy for patients with EGFR-mutated non-squamous non-small-cell lung cancer who progressed on EGFR tyrosine-kinase inhibitor therapy (ORIENT-31): first interim results from a randomised, double-blind, multicentre, phase 3 trial.Lancet Oncol. 2022;23(9):1167-1179.
- WenfengFang, Ying Cheng, ZhendongChen. et al. Updated efficacy and safety of anti-TROP2 ADC sacituzumabtirumotecan(sac-TMT) for previously treated advanced NSCLC in phase 2 study. 2024AACR CT247.
- Luis Paz-Ares, Myung-Ju Ahn, Aaron Lisberg, et al. TROPION-Lung05: Datopotamab deruxtecan (Dato-DXd) in previously treated non-small cell lung cancer with actionable genomic alterations. 2023 ESMO 1314MO.
- Myung-Ju Ahn, Aaron Lisberg, Luis Paz-Ares. et al. Datopotamab deruxtecan (Dato-DXd) vs docetaxel in previously treated advanced/metastatic (adv/met) non-small cell lung cancer (NSCLC): Results of the randomized phase 3 study TROPION-Lung01. 2023 ESMO LBA12.
- Luis G. Paz-Ares, Oscar juan-Vidal, Giannis S. Mountzios,et al. Sacituzumab Govitecan vs Docetaxel in Patients WithMetastatic Non-small Cell Lung Cancer Previously Treated WithPlatinum-Based Chemotherapy and PD-(L)1 Inhibitors: PrimaryResults From the Phase 3 EVOKE-01 Study. 2024ASCO LBA8500.
- Jacob Sands, Aaron Lisberg, Isamu Okamoto, et al. Datopotamab Deruxtecan vs Docetaxel in Patients with Non-Small Cell Lung Cancer: Final Overall Survival from TROPION-Lung01. 2024WCLC OA08.03.
- Wenfeng Fang, Qiming Wang, Ying Cheng, et al. Sacituzumab Tirumotecan (sac-TMT; Also Known as SKB264/MK-2870) in Combination With KL-A167 (Anti‒PD-L1) as First-Line Treatment for Patients With Advanced NSCLC From the Phase II OptiTROP-Lung01 Study.2024ASCO Abstract 8502
- Yasushi Goto, Wu chou Su, Benjamin Levy, et al. TROPlON-Lung02: Datopotamab Deruxtecan(Dato-DXd)Plus Pembrolizumab With or WithoutPlatinum Chemotherapy in Advanced Non-SmalCell Lung cancer. 2023 ASCO Abstract9004.
- Benjamin Philip Levy , Luis G. Paz-Ares , Wu-Chou Su , et al. Datopotamab deruxtecan (Dato-DXd) plus pembrolizumab (pembro) with or without platinum chemotherapy (Pt-CT) as first-line (1L) therapy for advanced non-small cell lung cancer (aNSCLC): Subgroup analysis from TROPION-Lung02. 2024ASCO abstract 8617.
- B.C. Cho, M.C. Dols, R. Reyes Cabanillas, et al. Sacituzumab Govitecan + Pembrolizumab in 1L Metastatic Non-Small Cell Lung Cancer: Preliminary Results of the EVOKE-02 Study. 2023WCLC OA05.04.
- T. Cascone, G. Florian, L. Bonanno, M, et al. Efficacy and Safety of Neoadjuvant Durvalumab (D) + Novel Anticancer Agents + CT and Adjuvant D ± Novel Agents in Resectable NSCLC. 2024 WCLC, PL02.07.
- M.C. Garassino, et al. Normalized Membrane Ratio of TROP2 by Quantitative Continuous Scoring is predictive of Clinical Outcomes in TROPION-Lung 01. 2024WCLC PL02.11.

 2023郑和论坛在北京成功举办
2023郑和论坛在北京成功举办